
Avrupa Birliği, 1223/2009 sayılı Kozmetik Yönetmeliği’nin Ek III (kısıtlı maddeler) ve VI’sını (onaylı UV filtreleri) değiştirmeyi amaçlayan bir Yönetmelik taslağını WTO’ya iletmiştir.
Esas olarak dört bileşen söz konusudur: BHT, Homosalate, HAA299, Acid Yellow 3, Resorcinol
BİLDİRİM TARİHİ
12 Nisan 2022
KAPSANAN ÜRÜNLER
Kozmetik Ürünler
BİLDİRİLEN DOKÜMANIN BAŞLIĞI
Draft Commission Regulation (EU) …/…of XXX amending Annexes III and VI to Regulation (EC)
No.1223/2009 of the European Parliament and of the Council
İÇERİK
Komisyon Tüzüğü taslağı tarafından önerilen önlemler, 1223/2009 (Kozmetik Yönetmeliği) Tüzüğün (EC) Eklerinin sürekli ve düzenli uyarlamalarının bir parçasıdır. Tüketici Güvenliği Bilimsel Komitesinin (SCCS) en son bilimsel Görüşlerine dayanarak, önerilen önlemler şunları amaçlamaktadır:
• Kozmetik ürünlerde antioksidan olarak kullanılan Bütillenmiş Hidroksitoluen (BHT) maddesi için Ek III’te kısıtlamalar oluşturmak
• Saç boyası olarak kullanılan Acid Yellow 3 maddesi için Ek III’te kısıtlama oluşturmak
• Saç boyası olarak kullanılan Resorcinol maddesi için Ek III’teki mevcut etiketleme gerekliliklerinde değişiklik yapılması
• Bis-(Dietilaminohidroksibenzoil Benzoyl) Piperazine (HAA299) maddesini Ek VI’da listeleyerek kozmetik ürünlerde UV filtresi olarak kullanımını onaylama
• Ek VI’daki mevcut kısıtlamaları değiştirerek kozmetik ürünlerde UV filtresi Homosalate’in kullanımının daha da kısıtlanması
Amaç
İnsan sağlığı ya da güvenliğini korumak
Gelecek Yönetmeliğin Metni
- Uluslararası Kozmetik Bileşenler İsimlendirmesi (INCI) kapsamında BHT adı verilen 2,6-Di-Tert-Bütil-4-Metilfenol (CAS No.128-37-0) maddesi şu anda Yönetmelik (EC) No.1223/2009 kapsamında düzenlenmemiştir. BHT, havaya maruz kaldığında ürünlerin özelliklerini ve performansını korumaya yardımcı olan ve kozmetikte yaygın olarak kullanılan sentetik bir antioksidandır.
- BHT’nin potansiyel endokrin bozucu özelliklerine ilişkin endişeler ışığında, Komisyon 2019’da halka açık bir veri çağrısı başlattı. Endüstri, BHT’nin kozmetik ürünlerde kullanıldığında güvenliğini göstermek için bilimsel kanıtlar sundu. Komisyon, Tüketici Güvenliği Bilimsel Komitesinden (SCCS) sağlanan bilgiler ışığında BHT için bir güvenlik değerlendirmesi yapmasını istedi.
- SCCS, 2 Aralık 2021 tarihli görüşünde, BHT’nin, ürün kategorileri ayrı ayrı veya birlikte kullanıldığında ağız çalkalama ürünlerinde maksimum %0,001, diş macununda %0,1 ve diğer durulanan ve durulanmayan ürünlerde ayrı veya birlikte kullanıldığında %0,8 konsantrasyonuna kadar güvenli bir bileşen olduğu sonucuna varmıştır.
- SCCS Görüşü ışığında, BHT’nin bu maddenin konsantrasyonu belirli seviyeleri aştığında, ağız çalkalama suyu, diş macunu ve diğer durulanan ve durulanmayan ürünlerde kullanılmasından kaynaklanan potansiyel insan sağlığı riski olduğu sonucuna varılabilir. Bu nedenle, bu ürünlerde BHT kullanımı sırasıyla %0,001, %0,1 ve %0,8 maksimum konsantrasyonla sınırlandırılmalıdır.
- INCI adı Acid Yellow 3 olarak atanan 1H-Indene-1,3(2H)-dion, 2-(2-quinolinyl)-, sülfonatlı, sodyum tuzları (CAS n°8004- 92-0), (EC) No.1223/2009 Ek IV’ün 82. girişi altında listelenmiştir ve bu nedenle herhangi bir maksimum konsantrasyon olmaksızın kozmetik ürünlerde renklendirici olarak kullanılmasına izin verilir.
- Oksidatif olmayan saç boyama ürünlerinde Acid Yellow 3 kullanımına ilişkin endüstri tarafından sağlanan verilere dayanarak, SCCS 23 Temmuz 2021 tarihli görüşünde, Acid Yellow 3’ün bu tür ürünlerde kafa üstü kullanıldığında %0,5’e kadar olan konsantrasyonlarda güvenli olduğu sonucuna varmıştır.
- SCCS Görüşü ışığında, Acid Yellow 3’ün oksidatif olmayan saç boyama ürünlerinde o maddenin konsantrasyonu belirli bir düzeyi aştığında kullanılmasından kaynaklanan potansiyel insan sağlığı riski olduğu sonucuna varılabilir. Bu nedenle, bu ürünlerde Acid Yellow 3 kullanımı maksimum %0,5 konsantrasyonla sınırlandırılmalıdır.
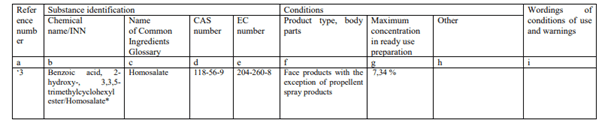
- INCI adı Homosalate olan Benzoik asit, 2-hidroksi-, 3,3,5-trimetilsikloheksil ester (CAS No.118-56-9), 1223/2009 numaralı yönetmeliğin Ek VI 3. girdide listelenmiştir ve bu nedenle kozmetik ürünlerde UV filtresi olarak kullanıma hazır ürünlerdeki maksimum %10 konsantrasyonda kullanılmasına izin verilir.
- Homosalate’in potansiyel endokrin bozucu özelliklerine ilişkin endişeler ışığında, Komisyon 2019’da halka açık bir veri çağrısı başlattı. Endüstri, kozmetik ürünlerde kullanıldığında Homosalate’in güvenliğini göstermek için bilimsel kanıtlar sundu. Komisyon, SCCS’den sağlanan bilgiler ışığında bir Homosalate güvenlik değerlendirmesi yapmasını istedi.
- SCCS, 24-25 Haziran 2021 tarihli Görüşünde, kozmetik ürünler Homosalate’ın UV filtresi olarak kullanıldığında %10’a kadar konsantrasyonlarında güvenli olmadığı sonucuna varmıştır. SCCS, kozmetik ürünlerde UV filtresi olarak Homosalate kullanımının, nihai üründe maksimum %0,5 konsantrasyonuna kadar tüketici için güvenli olduğunu bulmuştur.
- 30 Temmuz 2021’de, endüstri UV filtrelerinin geniş kullanılabilirliğini ve dolayısıyla tüketiciler için yeterli güneş korumasını sağlamak için, yalnızca yüz ürünlerinde (yüz kremi ve pompalı sprey ürünleri) Homosalate kullanımına dayalı güvenlik marjının yeniden hesaplanmasını sundu. SCCS, endüstri tarafından sağlanan bilgilere dayanarak ve Homosalate’in potansiyel endokrin bozucu özellikleriyle ilgili endişeleri göz önünde bulundurarak, 2 Aralık 2021’de Bilimsel tavsiye yayınladı ve Homosalate’ın yüz ürünlerinde krem ve pompa sprey şeklinde kullanıldığında %7,34’e kadar olan konsantrasyonlarının UV filtresi olarak güvenli olduğu sonucuna vardı. Bu nedenle, Homosalate kullanımı yalnızca yüz ürünleriyle (sprey olmayan ve pompalı sprey ürünler) maksimum %7,34 ile sınırlandırılmalıdır. Tüm kozmetik ürünlerde %0,5’e kadar ve yüz ürünlerinde %7,34’e kadar Homosalate’in kombine kullanımı, bu tür bir kombine kullanımın güvenlik marjı 100’ün altında olduğundan SCCS tarafından güvenli kabul edilmemektedir.
- SCCS bilimsel tavsiyesi ışığında, kozmetik ürünlerde UV filtresi olarak Homosalate’in halihazırda izin verilen konsantrasyonda kullanılmasından kaynaklanan insan sağlığı için potansiyel bir risk olduğu sonucuna varılabilir. Bu nedenle, Homosalate kullanımı yalnızca maksimum %7,34 konsantrasyona kadar yüz ürünleriyle (sprey olmayan ve pompalı sprey ürünler) sınırlandırılmalıdır.
- INCI adı Bis- (Dietilaminohidroksibenzoil Benzoil) olarak atanan 1,1′-(1,4-piperazindiil) bis[1-[2-[4-(dietilamino)-2-hidroksibenzoil]fenil]-metanon maddesi Piperazin (HAA299), UV filtresi işlevlerine sahip olarak bildirilen bir kozmetik bir bileşendir. HAA299 şu anda 1223/2009 (EC) sayılı Yönetmelik kapsamında düzenlenmemiştir.
- 2009’da Komisyon, kozmetik ürünlerde HAA299’un (mikronize ve mikronize olmayan) güvenli kullanımını desteklemek için endüstriden bir dosya aldı ve bu dosya 2012’de ek bilgilerle daha da doğrulandı. SCCS 23 Eylül 2014 tarihli bir Görüşünde şu sonuca varmıştır: HAA299’un nano olmayan formda (mikronize veya mikronize olmayan, medyan partikül boyutu dağılımı yaklaşık 134 nm veya daha büyük) kozmetik ürünlerde UV filtresi olarak %10’a kadar konsantrasyonda kullanımı insanlarda sistemik toksisite riski oluşturmaz. Ayrıca SCCS, görüşünün nano parçacıklardan oluşan HAA299’un güvenlik değerlendirmesini kapsamadığını belirtti.
- HAA299’un nano olmayan formuna ilişkin bu görüş ışığında, endüstri Eylül 2020’de ek veriler sunmuş ve maksimum %10 konsantrasyona kadar UV filtresi olarak kullanılması amaçlanan nano formda HAA299’un güvenliğinin değerlendirilmesini talep etmiştir.
- SCCS, 26 ve 27 Ekim 2021 tarihli görüşünde, sağlanan özellikler kapsamında (minimum saflık %97’ye eşit veya daha yüksek, partikül sayısı açısından medyan partikül boyutu 50 nm’ye eşit veya daha yüksek) nano formda HAA299 olduğu sonucuna varmıştır. Dermal olarak uygulanan kozmetik ürünlerde maksimum %10 konsantrasyona kadar UV filtresi olarak kullanıldığında güvenlidir. HAA299 (nano) içeren ürünlere akut inhalasyon maruziyetinin ardından akciğer üzerindeki inflamatuar etkileri göz önünde bulundurarak, SCCS, inhalasyon yoluyla tüketicinin akciğerlerinin maruz kalmasına yol açabilecek uygulamalarda HAA299 (nano) kullanımını önermedi.
- SCCS sonunda, önceki görüşünün revizyonunu sağlayacak herhangi bir veri sağlanmadığı ve bu nedenle HAA299’un hem nano olmayan hem de nano formu kozmetik ürünlerde UV filtresi olarak kullanıldığında maksimum %10 konsantrasyona kadar güvenli kabul edilebileceği sonucuna vardı. SCCS ayrıca, bir kozmetik üründe HAA299’un nano olmayan ve nano formlarının birleşik maksimum konsantrasyonunun %10’u geçmemesi gerektiğini düşünmektedir.
- SCCS görüşü ışığında, HAA299’un kozmetik ürünlerde UV filtresi olarak kullanılmasının, o maddenin konsantrasyonu belirli bir seviyeyi aştığında insan sağlığı için potansiyel bir risk olduğu sonucuna varılabilir. Bu nedenle, bu ürünlerde HAA299 kullanımı maksimum %10 konsantrasyonla sınırlandırılmalıdır. HAA 299 (nano) ile ilgili olarak, akciğerlerin maruz kalmasına neden olabilecek uygulamalarda kullanımına ilişkin bir koşul getirilmelidir.
- Bu nedenle (EC) No.1223/2009 Yönetmeliği değiştirilmeli ve buna göre düzeltilmelidir.
- Sadece yeni gereksinimlere uygun kozmetik ürünlerin piyasaya sürülmesini sağlamak için ürün formülasyonlarında gerekli düzenlemelerin yapılması da dahil olmak üzere, sektöre yeni gereksinimlere uyum sağlaması için makul süreler tanınmalıdır. Sektöre, bu gerekliliklere uymayan kozmetik ürünleri geri çekmesi için de makul bir süre tanınmalıdır. Homosalate için yeni kısıtlamalar ile ilgili olarak, bu UV filtresini içeren ürünlerin yeniden formüle edilmesi teknik olarak zordur ve yeniden formüle edilmiş ürünlerin güneş koruma faktörünün etkinliğini ölçmek gereklidir. Bu nedenle, endüstrinin Homosalate içeren ürünlerin yeni kısıtlamalara uyumunu sağlaması için daha uzun geçiş sürelerine izin verilmelidir.
- INCI adı Resorsinol olarak atanan 1,3-benzendiol (CAS No.108-46-3) maddesi şu anda 1223/2009 sayılı Tüzüğün (EC) Ek III’ün 22. girişinde oksidatif saç boyası ürünlerinde, kirpikleri renklendirmeye yönelik ürünler ve saç losyonları ve belirli kısıtlamalarla birlikte şampuanlarda kullanıma izin verildiği şekilde listelenmiştir. Oksidatif saç boyası ürünleri ile ilgili olarak, etiket şu uyarıyı içerecektir: “Kirpik veya kaş boyamak için kullanmayın”.
- 11 Temmuz 2013 tarihinde yürürlüğe giren (EC) 1223/2009 Sayılı Yönetmelikteki “saç ürünü” tanımına göre saç ürünü, kirpikler hariç baş veya yüz saçına uygulanmak üzere tasarlanmış kozmetik ürün anlamına gelir. Kirpiklerin burada hariç tutulması, kozmetik ürünler sırasıyla kafadaki saçlara ve kirpiklere uygulandığında risk seviyesinin farklı olması nedeniyle motive olmuştur.
- (EC) No.1223/2009 Ek III’teki 22. giriş, kirpikleri renklendirmeye yönelik ürünlerde Resorsinol’ün profesyonel kullanımına izin vermek için (AB) 1197/2013 sayılı Komisyon Yönetmeliği ile değiştirilmiştir. O zamanlar, Resorsinol’ün kaş boyama amaçlı ürünlerde kullanımına, yeni tanım dikkate alınarak “oksidatif saç boyası ürünleri” ürün tipine dahil edildiği için izin verildiğinden, kaş kullanımına ilişkin uyarının silinmesi gerekirdi. O hata düzeltilmelidir.
- Bu Yönetmelikte sağlanan önlemler, Kozmetik Ürünler Daimi Komitesinin görüşüne uygundur.
Maddeler
Madde 1
İyileştirmeler
Yönetmelik (EC) No.1223/2009 Yönetmeliğin Ek III ve VI’sı, bu yönetmeliğin Eki uyarınca değiştirilmiştir.
Madde 2
Düzeltme
Yönetmelik (EC) No.1223/2009 Ek III’de, 22. girişte, sütun 1, (a) kısmı, son cümle aşağıdaki ile değiştirilmiştir: “Kirpikleri boyamak için kullanmayın.”
Madde 3
Yürürlüğe giriş
Bu Tüzük, Avrupa Birliği Resmi Gazetesinde yayımlandığı tarihi izleyen yirminci gün yürürlüğe girecektir.
Bu Tüzük bütünüyle bağlayıcı olacak ve tüm Üye Devletlerde doğrudan uygulanacaktır.
1223/2009 Sayılı Yönetmelik Eklerinde Önerilen Değişiklikler
(1) Ek III’e aşağıdaki girişler eklenir.

* … [bu Yönetmeliğin yürürlüğe girdiği tarihi takip eden 6 ayı takip eden ayın ilk gününden] itibaren, bu maddeyi içeren ve kısıtlamalara uymayan oksidatif olmayan saç boyaları Birlik piyasasına arz edilemez. … [bu Yönetmeliğin yürürlüğe girdiği tarihten itibaren 12 ayı takip eden ayın ilk gününden] itibaren, bu maddeyi içeren ve kısıtlamalara uymayan oksidatif olmayan saç boyaları Birlik pazarında satışa sunulmayacaktır. **Renklendirici olarak kullanım için bkz. Ek IV, giriş No.82.
(2) Ek VI aşağıdaki gibi iyileştirilecektir.
(a) 3. Giriş aşağıdaki ile değiştirilecektir.
(b) Aşağıdaki girişler eklenecektir.

*Bis-(Dietilaminohyd-roxybenzoyl Benzoyl) Piperazine ve Bis-(Diethylaminohyd-roxybenzoyl Benzoyl) Piperazine (nano)’nun birlikte kullanılması durumunda toplam %10’u geçmeyecektir.

